BEFuel: Nachhaltige Wertstoffproduktion aus Abwässern und Abgasen
Kontakt: Beyzanur Cicec, Dirk Tischler
Kooperation: Ruhr-Universität Bochum | Lehrstuhl für Siedlungswasserwirtschaft und Umwelttechnik & Anorganische Chemie; SolarSpring GmbH; Emschergenossenschaft Lippeverband (EGLV); Institut für Automation und Kommunikation e.V. (ifak); Fraunhofer UMSICHT
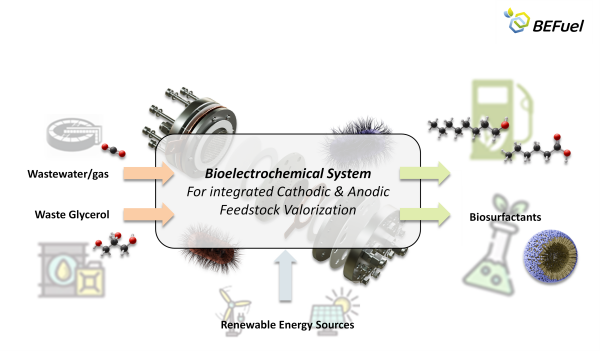
Das Verbundprojekt BEFuel („Gekoppelte bioelektrochemische Produktion von E-Fuels und hochwertigen Chemikalien aus Abgasen und Abwässern“) zielt darauf ab, aus Abwässern und Abgasen neue Wertstoffe zu gewinnen. Das bioelektrochemische System ermöglicht die Produktion von organischen C6- und C8-Säuren, die als Ausgangsstoffe für Biodiesel und Biogas dienen.
Durch die Fixierung von CO2 und die Nutzung von grünem Wasserstoff können Mikroorganismen hochwertige Chemikalien herstellen. Der grüne Wasserstoff wird mittels Elektrolyse von Abwässern aus einer Kläranlage produziert. An der Anode des Elektrolyseurs kommt Rohglycerin, ein Abfallprodukt der Biodieselproduktion, zum Einsatz. Die Oxidationsprodukte des Glycerins werden von weiteren Mikroorganismen genutzt, um Biotenside zu bilden.
Finanzierung: Das Projekt BEFuel wird vom Bundesministerium für Forschung, Technologie und Raumfahrt (BMFTR) gefördert.
Pressemitteilung: https://www.umsicht.fraunhofer.de/de/presse-medien/pressemitteilungen/2024/industrielle-biooekonomie.html
Establishing a Pan-European Network on Computational Redesign of Enzymes (COZYME)
Kontakt: Dirk Tischler

Die Initiative COZYME (COmputationally assisted design of enZYMEs) umfasst ein europaweites Kooperationsnetz, das auf die Entwicklung und Umsetzung modernster rechnergestützter Werkzeuge für die schnelle Verbesserung von Enzymen abzielt. Damit soll ein zentraler Engpass in der Biotechnologie gelöst werden: die Nutzung industriell relevanter Enzyme. Im Einzelnen konzentriert sich das Netzwerk auf drei Themen:
1. Verbesserung der allgemeinen Enzymeigenschaften wie Stabilität und Löslichkeit;
2. Optimierung der katalytischen Eigenschaften, z. B. Aktivität und Stereoselektivität;
3. Weiterentwicklung von experimentellen Ansätzen zur Erstellung und Bewertung von bioinformatischen Vorhersagen;
Diese Ziele sollen vor allem im Rahmen der Ausbildung junger Forscher in der Entwicklung und Nutzung von computergestützten Methoden in der Biotechnologie zugutekommen.
Laufzeit: Oktober 2022 – Oktober 2026
Finanzierung: European Cooperation in Science and Technology (COST)
Link: https://www.cost.eu/actions/CA21162/
BiodeCCodiNNg
DC 8 - Towards N-N bond formation via N-hydroxylation in a biocatalytic cascade
Kontakt: Dirk Tischler

Von der Entdeckung von Enzymen bis zur industriellen Umsetzung - die Entwicklung neuartiger Biokatalysatoren für die industrielle und pharmazeutische Biotechnologie: Das sind die Schwerpunkte unseres von der EU geförderten Doktoranden-Netzwerks. Dabei kombinieren wir Grundlagenforschung und angewandte Technik, um neue Synthesewege zu chemisch relevanten Produkten auf effizientere und sauberere Weise als bisher zu ermöglichen. Das Gesamtprojekt umfasst drei Arbeitspakete (AP1: Enzym-Entdeckung und Charakterisierung neuartiger NN- und CC-Enzyme; AP2: Strukturaufklärung und Enzym-Engineering für neue Reaktivitäten; und AP3: Reaction Engineering und biokatalytische Anwendungen), die sowohl in Forschungsinstituten als auch in der Industrie untersucht werden.
Unser Teil ist wichtig für die NN-knüpfenden Enzyme, da wir uns auf die Aktivierung von Amingruppen mittels N-hydroxylierender Enzyme konzentrieren. Dabei setzen wir Methoden ein, um Enzyme aus phylogenetischer Sicht zu beschreiben, mechanistische Details aufzudecken, sie durch rationales Design weiterzuentwickeln und Enzyme durch Immobilisierungstechniken zu stabilisieren.
Finanzierung: Das Doktorandennetzwerk wird im Rahmen der MARIE SKŁODOWSKA-CURIE ACTIONS finanziert (ID: 101073065)
Link: https://biodeccodinng.eu/
Glutathion im Metabolismus von Actinobakterien
Kontakt: Max Scholz, Dirk Tischler
Ein neuer Styrol-Abbauweg im Actinobakterium Gordonia rubripertincta CWB2 nutzt einen Glutathion-abhängigen Schritt. Im Rahmen dieses Projekts untersuchen wir die neuen Enzyme aus dem Stamm CWB2: Glutathion S-Transferase und Glutathion-Reduktase. Es kommen allgemeine Klonierungs- und Proteinproduktionsmethoden in Kombination mit hoch entwickelten UHPLC- und LC-MS-Methoden zum Einsatz, um Enzymaktivitäten zu charakterisieren. Darüber hinaus setzen wir Mutagenesestrategien ein, um ausgewählte Gene im Stamm CWB2 auszuschalten oder andere unter ausgewählte Regulatoren zu bringen, um das gen-silencing sowie die Expression in diesem Actinobakterium zu ermöglichen.
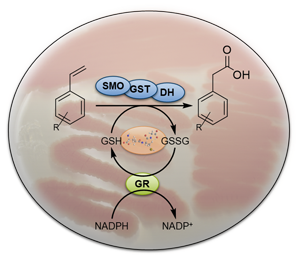
Finanzierung: Das Projekt wird von der DFG-geförderten Research Training Group MiCon (RTG 2341) unterstützt.
Darüber hinaus erhalten wir Unterstützung für das Projekt vom Mercator Research Center Ruhr (An-2018-0044).
Biotransformation of lignin-monomers by flavin-dependent oxidases
Kontakt: Nils Weindorf, Tobias Rapsch, Dirk Tischler
Kooperation: Willem J.H. van Berkel, Wageningen University; Andrea Mattevi, University of Pavia
Flavin-abhängige Oxidasen spielen eine zentrale Rolle in der Biokatalyse, weisen jedoch häufig Limitationen in Stabilität und Substratspezifität auf. Durch Homologie-Modellierung sollen neue Enzyme mit erweitertem Substratspektrum identifiziert werden. Darüber hinaus arbeiten wir an der Optimierung geeigneter Enzyme durch die Kombination klassischer Enzymkinetiken mit KI-gestützten Strukturvorhersagen. Aufbauend auf diesen Daten werden gezielte Mutationen durchgeführt, um Aktivität, Stabilität und Substratbreite durch Enzyme-Engineering zu verbessern. Die optimierten Biokatalysatoren werden anschließend in Multi-Enzymkaskaden eingesetzt, vorzugsweise immobilisiert in zellfreien Systemen zur effizienten Umsetzung industriell relevanter Substrate.
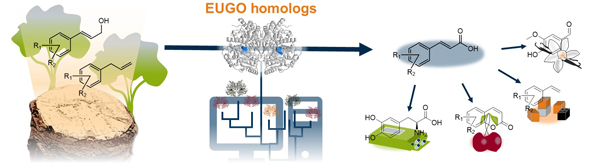
Förderung: Das Projekt wird durch ein Promotionsstipendium der Deutschen Bundesstiftung Umwelt für Nils Weindorf gefördert. Tobias Rapsch wird durch die DFG gefördert.
![]()
Kontakt: Carolin Mügge
Das Projekt BioCOnversion vereint multidisziplinäres Fachwissen aus Wissenschaft und Industrie in einem grenzüberschreitenden Konsortium, um CO-haltige Prozessgase für die Produktion von Chemikalien mit Mehrwert verfügbar zu machen. Das Bundesministerium für Bildung und Forschung (BMBF) fördert diesen innovativen Bioprozess zur Umwandlung von Synthesegas in ein definiertes Kunststoffvorprodukt und derBewertung verschiedener Technologieansätze.
Kohlenmonoxid (CO)-haltige Prozessgase, die an zahlreichen Industriestandorten in der BIG-Cluster-Region reichlich vorhanden sind, können wertvolle Ausgangsstoffströme für die biotechnische Herstellung von (Synthese)Bausteinen sein, die derzeit über petrochemische Prozessrouten hergestellt werden. Von besonderem industriellen Interesse sind mittelkettige Kohlenstoffverbindungen mit multifunktionellen Gruppen. Da sie konventionell aus fossilen Ressourcen erzeugt werden, wären Routen, die erneuerbare Non-Food-Rohstoffe zur Bereitstellung solcher Vorläuferstoffe nutzen, ein wichtiger Schritt zur Etablierung einer nachhaltigen Wirtschaft. Das Projekt BioCOnversion zielt auf die Entwicklung und Umsetzung eines nachhaltigen Prozesses von CO hin zu einem definierten Polymer-Precursor durch die Evaluierung verschiedener Technologien. Ein internationales Konsortium aus industriellen und akademischen Partnern verbindet ihr hochrangiges, multidisziplinäres Fachwissen, um einen Prozess zu entwickeln, der die primäre Umwandlung von CO/Syngas in ein Zwischenprodukt durch Gasfermentation und dessen enzymatische Aufwertung zu einem definierten Kunststoffvorläufer umfasst.
Der an der RUB bearbeitete Teil des Projekts konzentriert sich auf die enzymatische Aufwertung des durch Synthesegas-konvertierende Mikroorganismen produzierten Zwischenprodukts. Dabei wird das gesamte Spektrum der Stamm- und Enzymoptimierung sowie der Reaktionsoptimierung angegangen. Das Projekt wird durch mechanistische Studien an den Zielenzymen untermauert.
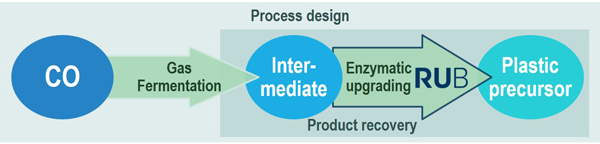
Externe Links: https://www.bigc-initiative.eu/bioconversion.php
Press release: pdf
Finanzierung: Das Projekt wird durch das BMBF (03INT513BF) im Rahmen der BIG-Cluster-Initiative gefördert.
ChemBioCat
Kontakt: Carolin Mügge, Dirk Tischler
Kooperation: Prof. Dr. Pablo Sobrado, Virginia Tech, Blacksburg
In dem Projekt sollen neue chemo-enzymatische Kaskaden entwickelt werden, die zur Produktion wertvoller Verbindungen genutzt werden können. Zwei Teilprojekte werden verfolgt:
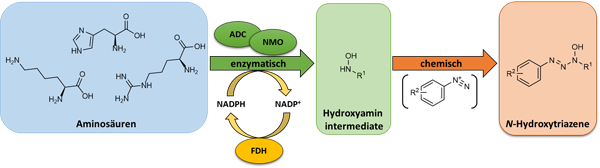

Hydroxytriazene und Hydroxytriazole sind wichtige Feinchemikalien mit biologischer Aktivität, deren Effekt auf Bakterien, Pilze oder Einzelenzyme getestet werden kann.
Finanzierung: Das Projekt wird vom Bundesland Nordrhein-Westfalen durch Finanzierung einer Nachwuchsgruppe (PtJ-TRI/1411ng006) gefördert.
Abbau industriell-relevanter Azo-Farbstoffe
Kontakt: Anna Christina Ngo, Selvapravin Kumaran, Dirk Tischler
Kooperation: Dr. Isabel Bento, EMBL Hamburg
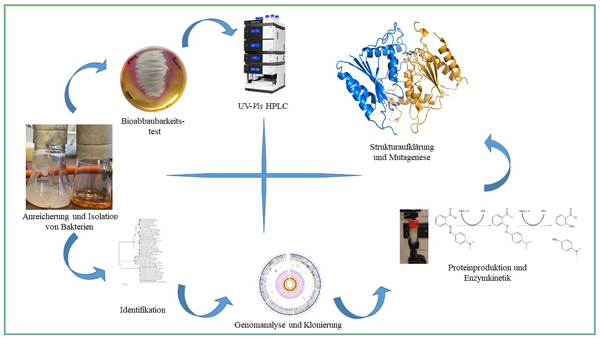
Im Rahmen des Projektes nutzen wir isolierte Enzyme oder neue bakterielle Isolate um Azo-Farbstoffe umzusetzen. Auf Seiten der Enzyme nutzen wir verschiedene Flavin-abhängige und – unabhängige Azo-Reduktasen und brechen so die Azo-Gruppe, was zu verschiedenen aromatischen Aminen führt. Als Prototyp nutzen wir die AzoRo aus Rhodococcus opacus 1CP, welche wir durch Protein-Engineering optimieren und strukturell charakterisieren. Auf der anderen Seite suchen wir nach Baktieren mit der Fähigkeit Azo-Farbstoffe abzubauen bzw. die diese sogar als alleinige C-Quelle nutzen können. Hier nutzen wir verschiedene Methoden der Funktionellen Genom-Annotation und Biodegradation in Kombination mit analytischer Chromatographie.
Förderung: Das Projekt wird durch Promotionsstipendium für Anna Christina Ngo durch den KAAD gefördert.
EnzymPrint
Kontakt: Dirk Tischler
Kooperation: Hirsch Engineering Solutions GmbH & Co. KG, Eichstätt
Das Projekt zielt auf die Immobilisierung von Enzymen auf bio-kompatiblen Materialien ab. Damit sollen neue Kaskaden ermöglicht werden. Als Beispiel soll die Synthese von Trehalose aus Glucosebausteinen und Polyphosphat erzeugt untersucht werden.

Externe Links: https://www.hirsch-es.de/
Finanzierung: Das Projekt wird als Kooperationsprojekt vom Bundesministerium für Wirtschaft und Energie (KK5161101CS0) gefördert.